Article mis à jour mai 2024
Pour fin de lecture, les chiffres encerclés réfèrent aux numéros des références annexées au présent document.
Le phénomène de la perméabilité intestinale est de plus en plus expliqué par la science et ce, depuis maintenant quelques années. Les données sont en constante évolution. Lorsqu’on parle de la perméabilité intestinale, on s’intéresse spécifiquement à la muqueuse, c’est-à-dire, à la paroi de l’intestin (1)(14). Une paroi saine est étanche et limite la circulation de molécules de l’intérieur de l’intestin vers l’extérieur et vice-versa (1)(14). Autrement dit, le contenu de l’intestin reste à l’intérieur de celui-ci alors que les molécules présentes dans la circulation sanguine ne peuvent pas pénétrer dans l’intestin (1)(14).
Qu’en est-il si ce niveau de perméabilité est altéré ? Est-ce que cela pourrait engendrer de l’inflammation non désirée pour l’équilibre de l’organisme, des problématiques ou des maladies ? À l’inverse, est-ce que certaines maladies seraient responsables de la perturbation de la muqueuse ? Toutes ces questions seront expliquées dans les sections suivantes.
Comprendre la muqueuse intestinale
La fonction de la muqueuse intestinale est certainement d’éviter une circulation de molécules non souhaitées, de part et d’autre de cette dernière (1)(2). La muqueuse est constituée d’une foule de cellules nommées les cellules épithéliales jouant un rôle de barrière physique (1)(2)(7). Ces dernières sont reliées entre elles par plusieurs composés dont les jonctions serrées (2)(6)(7)(14). Ces jonctions sont des composantes essentielles à la barrière intestinale et sont responsables du contrôle de ce qui peut circuler adéquatement (ex. eau, certains ions, sucres) et de ce qui ne devrait pas traverser (ex. bactéries pathogènes, éléments toxiques) (1)(2)(7)(13). On trouvent également une barrière immunitaire composée des cellules immunitaires bien précieuses, responsables de la gestion de l’immunité, comme les défensines, les lymphocytes et les macrophages (1)(2). Ainsi, les composantes physiques, cellulaires et chimiques de la barrière intestinale contribuent aux fonctions immunitaires (1).
Une hyperperméabilité intestinale, est-ce problématique ?
Vous l’aurez compris, une paroi saine n’est donc pas totalement étanche (1). Cependant, il est maintenant connu qu’une trop grande perméabilité est associée à certains symptômes et à certaines maladies (1)(13). Cette augmentation de la perméabilité intestinale est un signe d’une barrière intestinale perturbée (1)(6). Il s’agit de liens associatifs, pas de causalité. La nuance est importante, puisque bien des éléments restent à découvrir (1)(6).
Ainsi, les études ont observé une hyperperméabilité intestinale chez différentes populations (1)(4). À titre d’exemple, la dysfonction de la barrière intestinale et le syndrome de l’intestin « poreux » (leaky gut syndrome) pourraient être impliqués dans (1)(2)(4)(7)(8)(9)(11)(13)(14)(15):
- Le syndrome de l’intestin irritable (SII)
- SIBO (Small intestinal bacterial overgrowth)
- Les maladies inflammatoires de l’intestin (MII) comme la maladie de Crohn et la colite ulcéreuse
- Les maladies cardiovasculaires
- L’obésité
- La maladie cœliaque
- Stéatose hépatique non alcoolique (nommé souvent « foie gras »)
- L’arthrite rhumatoïde
- Le diabète de type 1 et de type 2
Plusieurs facteurs influencent la fonction de la barrière intestinale comme les composés de la barrière, l’alimentation, les antibiotiques, la médication, les bactéries intestinales, le stress et l’activité physique (1).
Perméabilité intestinale et inflammation
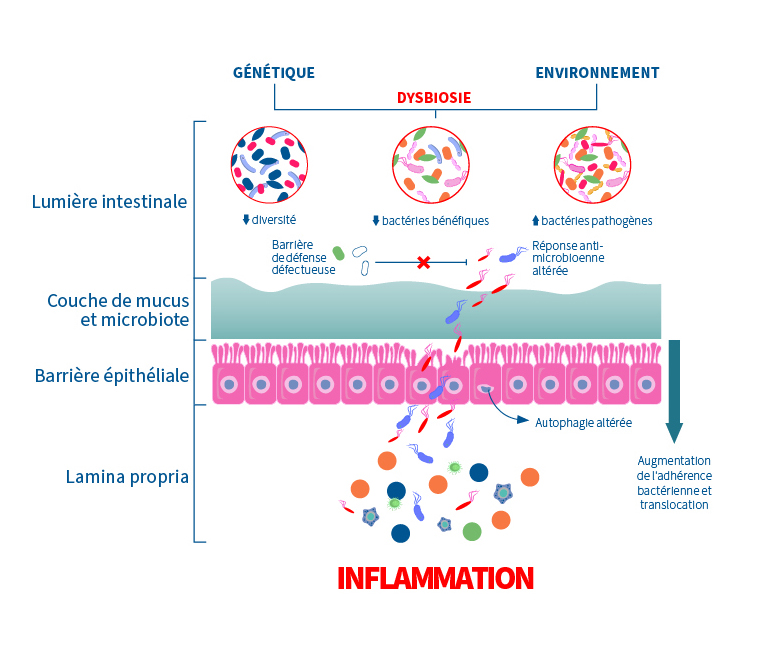
Comme mentionné précédemment, la muqueuse intestinale loge une foule de cellules immunitaires (1). Pour cette raison, une augmentation de la perméabilité intestinale mène à une réponse immunitaire qui appelle dans son processus, des molécules inflammatoires (3)(11)(15). Ce mécanisme, s’il devient chronique, peut à son tour induire une altération des jonctions; un réel cercle vicieux (3)(14). En effet, lors d’une augmentation de la perméabilité intestinale, l’entrée des bactéries et des composés inflammatoires dérivés du microbiote augmente dans le système circulatoire (1)(14)(15). Évidemment, l’objectif est de limiter cet effet. La perméabilité intestinale engendre un système immunitaire suractivé ce qui peut augmenter la signalisation de l’inflammation (11)(15).
Ce schéma résume bien l’état de la situation lors d’une altération de la barrière intestinale :
Comment valider la présence d’une perméabilité intestinale?
Bien qu’il existe sur le marché quelques tests permettant de confirmer ou d’infirmer le niveau de perméabilité intestinale, il y a un manque pour l’application clinique actuellement. Certains tests peuvent mesurer certaines protéines des membranes de la barrière comme la zonuline (1)(2)(14). En effet, la majorité des cliniciens utilisent leur expérience et leur jugement clinique pour suspecter un état de bon fonctionnement ou non. Quoique les gastroentérologues peuvent pratiquer une biopsie et ainsi constater physiquement le degré de perméabilité, mais ce n’est pas un examen de routine! On dit de la perméabilité, qu’elle est un symptôme et donc, qu’elle résulte d’une problématique existante (1)(9)(11)(14).
À cet effet, la combinaison de quelques-uns des éléments suivants peut permettre de soulever un drapeau rouge en matière de « leaky gut » (1)(2).
Lors de présence de (1)(2)(13) :
- Symptômes digestifs chroniques
- Intolérances non identifiées
- L’inflammation chronique
- Certains médicaments et antibiotiques
- Certaines bactéries pro inflammatoires dans la lumière intestinale
- Stress chronique
- Alimentation de type Western, très pauvre en fibres
Perméabilité et microbiote intestinal
On sait que la qualité du microbiote va de concert avec l’intégrité de la paroi intestinale (1)(4)(7)(14). En effet, plusieurs fonctions du microbiote sont liées à la régulation de la perméabilité intestinale dont le contrôle de la prolifération des bactéries pathogènes, la stimulation du système immunitaire et la synthèse des acides gras à chaîne courte (AGCC) (1)(14). Un déséquilibre du microbiote intestinal (dysbiose) altère les jonctions serrées qui permettent l’accès aux pathogènes et aux toxines (ex. lipopolysaccharides (LPS) (1)(7)(14).
Pour apprendre comment nourrir adéquatement votre microbiote, consulter l’article Alimentation et microbiote intestinal : ce que vous devez savoir !
Maintenant, qu’en est-il des recommandations générales actuelles en lien avec ce fameux« leaky gut »? Notez que ces recommandations sont préliminaires et doivent être adaptées à chaque personne, puisque le microbiote est unique à chaque individu (2). Voici tout de même un survol des aliments favorables et à limiter pour la santé de la barrière intestinale.
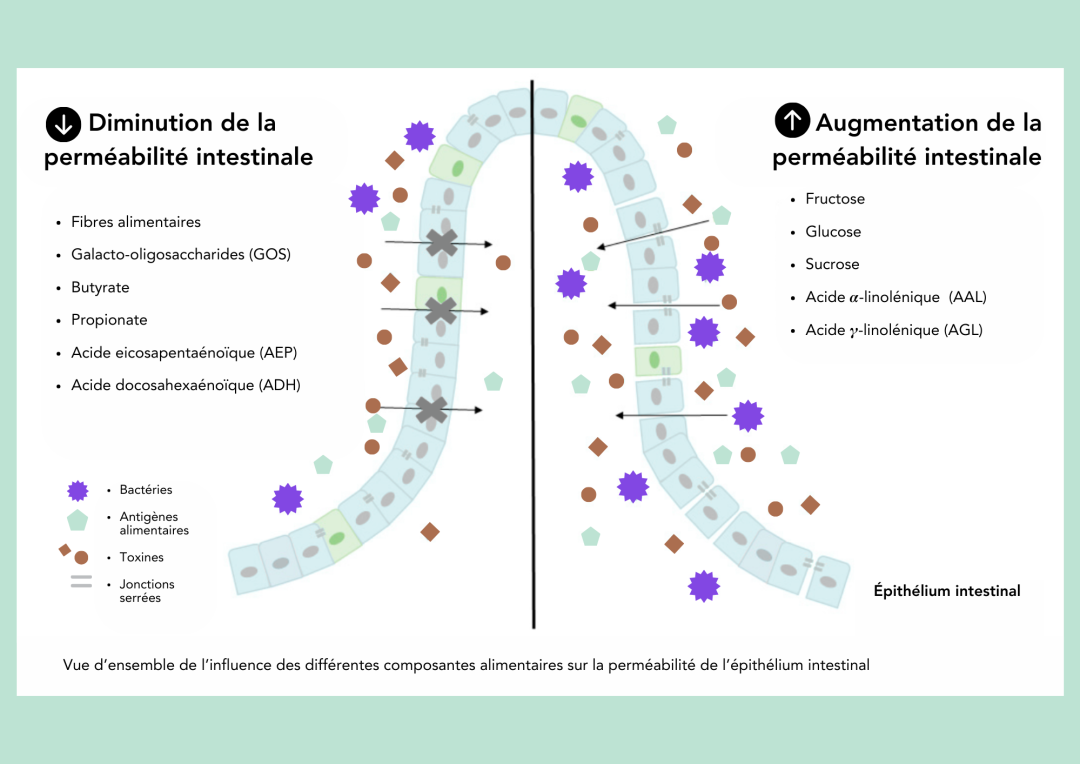
Adapté de Binienda et al. (2020) (2)
Consommer des gras de qualité
Intégrer au menu des gras en provenance des poissons et des végétaux est bénéfique pour la santé globale, dont la santé cardiovasculaire. À ce jour, leurs bienfaits s’étendent également à la santé intestinale, notamment, grâce à leur effet sur le microbiote intestinal (3). En ce sens, limiter la consommation de gras saturés (ex. viandes rouges et transformées) et optimiser la présence des oméga-3 (ex. poissons comme le saumon, la truite, le thon et les sardines) dans l’alimentation serait favorable pour la muqueuse intestinale (2)(3)(4)(6)(7)(15).
Favoriser les acides gras à chaîne courte
Une des molécules favorables pour améliorer la barrière intestinale sont les acides gras à chaîne courte (AGCC), composés synthétisés par les bactéries intestinales (1)(2)(6)(7). Le butyrate est un AGCC connu pour son effet favorable sur le maintien de l’intégrité de la barrière intestinale (2)(2)(6)(7)(13). En effet, une déficience en AGCC et en fibres alimentaires peut compromettre les fonctions épithéliales et de la barrière de la muqueuse en augmentant la perméabilité intestinale (1). Les AGCC sont synthétisés par les bactéries intestinales suite à la fermentation de certains aliments de choix. Parmi ceux-ci, on pense aux aliments riches en fibres (ex. grains entiers, fruits, légumes, noix et graines) et également aux aliments prébiotiques (ex. betteraves, inuline, ail, banane, poireau) (2)(4)(7).
Avoir une alimentation faible en sucres ajoutés
Une alimentation faible en sucre est certainement favorable pour maintenir les jonctions serrées…serrées (1)(2)(10). En effet, plusieurs études se sont penchées sur le rôle de différents sucres (fructose, glucose, sucrose) dans ce contexte (1)(10). Ces sucres ajoutés semblent être impliqués dans l’augmentation de la perméabilité intestinale et la dysfonction des jonctions serrés (1)(2)(10)(13). Certaines études ont observé que l’apport en fructose peut augmenter la perméabilité intestinale et promouvoir la libération des facteurs inflammatoires au foie augmentant ainsi l’inflammation du foie et systémique (ensemble du corps) (2)(10)(13). Par contre, les études sont encore préliminaires sur l’influence des différents types de sucres, ce qui amène à garder le focus sur les sucres ajoutés, de manière générale (2)(10). Miser sur une réduction des aliments commerciaux riches en sucres comme les biscuits, gâteaux, pâtisseries, barres tendres et céréales sucrées est donc à favoriser. Une lecture adéquate de la liste des ingrédients sera toujours un excellent allié en essayant que les synonymes de « sucre » se retrouvent le plus loin possible.
S’en tenir à une faible consommation d’alcool
Avec la nouvelle mise à jour sur les recommandations en lien avec la consommation d’alcool, il appert que la littérature est claire sur le sujet : moins on consomme d’alcool, mieux c’est pour la santé globale (5). La santé digestive ne fait pas exception (1)(6)(7). En effet, une consommation élevée d’alcool est associée à un plus grand risque de développer une perméabilité intestinale (1)(6). L’alcool peut inhiber les bactéries bénéfiques, favoriser une dysbiose ainsi qu’altérer la composition du microbiote associé à la muqueuse (1).
Vous êtes intéressés par les suppléments ?
L’effet potentiel de la prise orale de suppléments a fait l’objet de nombreuses recherches. Cela dit, soyez prudents! Toute prise de suppléments devrait se faire après une discussion auprès de vos professionnels de la santé.
Voici quelques exemples de suppléments en lien avec la barrière intestinale :
Glutamine
À ce jour, la glutamine semble être le supplément le plus prometteur pour optimiser le niveau de perméabilité intestinale (1)(6)(12). La glutamine est un acide aminé présent dans l’alimentation et synthétisé par le corps (1)(6)(12). Plusieurs études de culture cellulaire confirment en outre son rôle dans la régulation de l’intégrité des jonctions serrées épithéliales de la muqueuses (1)(6)(12). Cela dit, il est encore difficile de déterminer avec précision un dosage et un contexte optimal (1)(6)(12). Pour cette raison, il pourrait être préférable de miser sur une alimentation riche en glutamine, en intégrant une variété d’aliments comme les légumineuses, les céréales, la viande, le poisson, les produits laitiers, qui sont de bonnes sources alimentaires de celle-ci.
Probiotiques
Certaines souches de bactéries semblent bien prometteuses quant à leur effet sur l’inflammation et le niveau de perméabilité de l’intestin (1). En effet, les principaux bienfaits associés aux probiotiques sont la régularité du transit intestinal, la production d’AGCC et leurs implications pour le mucus et le microbiote intestinal (1)(6). Parmi les bactéries étudiées, certaines souches de Lactobacillus stimulent l’intérêt des chercheurs (1). Ceux-ci ont été associés à un renforcement de la barrière de la muqueuse et une réduction de la perméabilité intestinale en régulant les jonctions serrées (1). Par contre, ces résultats sont issus principalement d’études précliniques et d’autres études sont nécessaires chez l’humain pour confirmer ces bienfaits (1).
Ainsi, il n’y a pas un seul « bon » probiotique. On doit plutôt chercher celui qui est adéquat pour vous selon les raisons de leur utilisation. Ce Guide clinique des probiotiques est une référence sur le sujet
Pour conclure, vous aurez compris que plusieurs éléments peuvent influencer la santé de la muqueuse intestinale (1). Évidemment, l’adoption de saines habitudes de vie de manière générale, aura un effet favorable sur cette dernière (1). Au-delà de ce principe, prendre en charge sa santé digestive, de manière à limiter la présence de symptômes ou d’inflammation chronique, sera certainement le meilleur atout (1)(11)(14). Voilà donc une raison de plus, de s’intéresser à ce qui se passe dans le merveilleux monde des intestins.
Références
(1) Aleman RS, Moncada M, Aryana KJ. Leaky Gut and the Ingredients That Help Treat It: A Review. Molecules. 2023 Jan 7;28( 2 ):619. doi: 10.3390/molecules28020619. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9862683/
(2) Binienda A, Twardowska A, Makaro A, Salaga M. Dietary Carbohydrates and Lipids in the Pathogenesis of Leaky Gut Syndrome: An Overview. International Journal of Molecular Sciences. 2020; 21(21):8368. https://doi.org/10.3390/ijms21218368
(3) Boulangé CL, Neves AL, Chilloux J, Nicholson JK, Dumas ME. Impact of the gut microbiota on inflammation, obesity, and metabolic disease. Genome Med. 2016 Apr 20;8( 1 ):42. doi: 10.1186/s13073-016-0303-2. https://genomemedicine.biomedcentral.com/articles/10.1186/s13073-016-0303-2
(4) Cani PD, Osto M, Geurts L, Everard A. Involvement of gut microbiota in the development of low-grade inflammation and type 2 diabetes associated with obesity. Gut Microbes. 2012 Jul-Aug;3( 4 ):279-88. doi: 10.4161/gmic.19625. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3463487/#:~:text=Compelling%20evidence%20supports%20the%20concept,grade%20inflammation%20associated%20with%20obesity.
(5) Centre canadien sur les dépendances et l’usage de substances (2023) Résumé grand public des Repères canadiens sur l’alcool et la santé : boire moins, c’est mieux (infographie), en ligne, consulté avril 2024, https://www.ccsa.ca/fr/resume-grand-public-des-reperes-canadiens-sur-lalcool-et-la-sante-boire-moins-cest-mieux
(6) De Santis S, Cavalcanti E, Mastronardi M, Jirillo E, Chieppa M. Nutritional Keys for Intestinal Barrier Modulation. Front Immunol. 2015 Dec 7;6:612. doi: 10.3389/fimmu.2015.00612. https://pubmed.ncbi.nlm.nih.gov/26697008/
(7) Di Vincenzo F, Del Gaudio A, Petito V, Lopetuso LR, Scaldaferri F. Gut microbiota, intestinal permeability, and systemic inflammation: a narrative review. Intern Emerg Med. 2024 Mar;19( 2 ):275-293. doi: 10.1007/s11739-023-03374-w. https://pubmed.ncbi.nlm.nih.gov/37505311/
(8) Kim D, Zeng MY, Núñez G. The interplay between host immune cells and gut microbiota in chronic inflammatory diseases. Exp Mol Med. 2017 May 26;49( 5 ):e339. doi: 10.1038/emm.2017.24. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5454439/
(9) Lazar V, Ditu LM, Pircalabioru GG, Gheorghe I, Curutiu C, Holban AM, Picu A, Petcu L, Chifiriuc MC. Aspects of Gut Microbiota and Immune System Interactions in Infectious Diseases, Immunopathology, and Cancer. Front Immunol. 2018 Aug 15;9:1830. doi: 10.3389/fimmu.2018.01830. https://pubmed.ncbi.nlm.nih.gov/30158926/
(10) Ma X, Nan F, Liang H, Shu P, Fan X, Song X, Hou Y, Zhang D. Excessive intake of sugar: An accomplice of inflammation. Front Immunol. 2022 Aug 31;13:988481. doi: 10.3389/fimmu.2022.988481. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9471313/
(11) Pickard JM, Zeng MY, Caruso R, Núñez G. Gut microbiota: Role in pathogen colonization, immune responses, and inflammatory disease. Immunol Rev. 2017 Sep;279( 1 ):70-89. doi: 10.1111/imr.12567. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5657496/
(12) Rao R, Samak G. Role of Glutamine in Protection of Intestinal Epithelial Tight Junctions. J Epithel Biol Pharmacol. 2012 Jan;5(Suppl 1-M7):47-54. doi: 10.2174/1875044301205010047. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4369670/
(13) Twardowska A, Makaro A, Binienda A, Fichna J, Salaga M. Preventing BacterialTranslocation in Patients with Leaky Gut Syndrome: Nutrition and PharmacologicalTreatment Options. International Journal of Molecular Sciences. 2022; 23( 6 ):3204. https://doi.org/10.3390/ijms23063204
(14) Wells JM, Brummer RJ, Derrien M, MacDonald TT, Troost F, Cani PD, Theodorou V, Dekker J, Méheust A, de Vos WM, Mercenier A, Nauta A, Garcia-Rodenas CL. Homeostasis of the gut barrier and potential biomarkers. Am J Physiol Gastrointest Liver Physiol. 2017 Mar 1;312( 3 ):G171-G193. doi: 10.1152/ajpgi.00048.2015. https://pubmed.ncbi.nlm.nih.gov/27908847/
(15) Zhao T, Wei Y, Zhu Y, Xie Z, Hai Q, Li Z, Qin D. Gut microbiota and rheumatoid arthritis: From pathogenesis to novel therapeutic opportunities. Front Immunol. 2022 Sep 8;13:1007165. doi: 10.3389/fimmu.2022.1007165. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9499173/